غاز كربوني
ثاني أكسيد الكربون (الصيغة الكيميائية CO2) هو مركب كيميائي عديم اللون بكثافة حوالي 53٪ أعلى من كثافة الهواء الجاف. تتكون جزيئات ثاني أكسيد الكربون من ذرة كربون واحدة مرتبطة تساهميًا بذرتين من الأكسجين. يحدث بشكل طبيعي في الغلاف الجوي للأرض كغاز نزر. يبلغ التركيز الحالي حوالي 0.04٪ (417 جزء في المليون) من حيث الحجم ، وهو ما يمثل زيادة عن مستويات ما قبل الثورة الصناعية على الأرض البالغة 280 جزء في المليون. يشكل محلولًا حمضيًا في الماء بسبب تكوين حمض الكربونيك (H2CO3). تشمل المصادر الطبيعية لثاني أكسيد الكربون البراكين وحرائق الغابات والينابيع الساخنة والسخانات ، وتنطلق من صخور الكربونات عن طريق الذوبان في الماء والأحماض. لأن ثاني أكسيد الكربون قابل للذوبان في الماء ، فإنه يتواجد بشكل طبيعي في المياه الجوفية والأنهار والبحيرات ، والغطاء الجليدي والأنهار الجليدية ومياه البحر. هناك احتياطيات من النفط والغاز الطبيعي. يحتوي ثاني أكسيد الكربون على رائحة حمضية نفاذة وطعمه مثل ماء الصودا في الفم ، ولكنه عديم الرائحة بتركيزاته الطبيعية.
كمصدر للكربون في دورة الكربون ، فإن ثاني أكسيد الكربون في الغلاف الجوي هو المصدر الرئيسي للكربون للحياة على الأرض ، وكان تركيزه في الغلاف الجوي قبل تصنيع الأرض ، ومنذ نهاية فترة ما قبل الكمبري ، كان تنظمها كائنات التمثيل الضوئي والظواهر الجيولوجية. تستخدم النباتات والطحالب والبكتيريا الزرقاء طاقة ضوء الشمس لتجميع الكربوهيدرات من ثاني أكسيد الكربون والماء في عملية تسمى التمثيل الضوئي ، والتي تنتج الأكسجين كمنتج نفايات.
في المقابل ، يتم استهلاك الأكسجين ويتم إطلاق ثاني أكسيد الكربون كنفايات بواسطة جميع الكائنات الهوائية حيث تقوم باستقلاب المركبات العضوية لإنتاج الطاقة من خلال التنفس. نظرًا لأن النباتات تحتاج إلى ثاني أكسيد الكربون من أجل التمثيل الضوئي ويعتمد البشر والحيوانات على النباتات في الغذاء ، فإن ثاني أكسيد الكربون ضروري للحياة على الأرض من أجل البقاء. يتم إرجاعها إلى الماء من خلال خياشيم الأسماك وإلى الهواء عبر رئتي الحيوانات الأرضية التي تتنفس الهواء ، بما في ذلك الإنسان. ينتج ثاني أكسيد الكربون أثناء عمليات تعفن المواد العضوية وتخمير السكريات في الخبز والبيرة وصناعة النبيذ. يتم إنتاجه من احتراق الأخشاب والجفت والمواد العضوية الأخرى والوقود الأحفوري مثل الفحم والنفط والغاز الطبيعي. إنه منتج ثانوي غير مرغوب فيه في العديد من عمليات الأكسدة واسعة النطاق ، على سبيل المثال ، يتم استخدامه في إنتاج حمض الأكريليك (أكثر من 5 ملايين طن سنويًا).
كان ثاني أكسيد الكربون أول غاز يوصف بأنه مادة منفصلة. حوالي عام 1640 ، لاحظ الكيميائي الفلمنكي جان بابتيست فان هيلمونت أنه عندما تم حرق الفحم في حاوية مغلقة ، كانت كتلة الرماد الناتجة أقل بكثير من الفحم الأصلي. كان تفسيره أن بقية الفحم قد تحول إلى مادة غير مرئية أطلق عليها "غاز" أو "روح برية" (سبيريتس سيلفستريس). تمت دراسة خصائص ثاني أكسيد الكربون في خمسينيات القرن الثامن عشر بواسطة الطبيب الاسكتلندي جوزيف بلاك. اكتشف أن الحجر الجيري (كربونات الكالسيوم) يمكن تسخينه أو معالجته بالأحماض لإنتاج غاز أسماه "الهواء الثابت". ولاحظ أن الهواء لا يزال أكثر كثافة من الهواء وليس له شعلة ولا داعم للحياة الحيوانية. وبدلاً من ذلك ، وجد أيضًا أنه عندما يمر عبر ماء الجير (محلول مائي مشبع بهيدروكسيد الكالسيوم) ، فإنه يترسب كربونات الكالسيوم.
استخدم هذه الظاهرة لإظهار أن ثاني أكسيد الكربون ينتج عن التنفس الحيواني والتخمير الميكروبي. في عام 1772 ، نشر الكيميائي الإنجليزي جوزيف بريستلي ورقة بعنوان تشبع الماء بهواء ثابت ، وصف فيها عملية تقطير حمض الكبريتيك (أو زيت الزاج كما عرفه بريستلي) على الجص لإنتاج ثاني أكسيد الكربون وإجبار الغاز على التحمل. وأوضح. عن طريق تحريك وعاء من الماء ، يذوب بالتلامس مع الغاز. تم تسييل ثاني أكسيد الكربون لأول مرة (تحت ضغط مرتفع) بواسطة همفري ديفي ومايكل فاراداي في عام 1823. وصف المخترع الفرنسي Adrien-Jean-Pierre Tellurier أول وصف لثاني أكسيد الكربون الصلب (الجليد الجاف) ، الذي فتح حاوية مضغوطة لثاني أكسيد الكربون السائل في عام 1835 ، لكنه وجد أن التبريد الناجم عن التبخر السريع للسائل هو. نتج عن ذلك "ثلج" من ثاني أكسيد الكربون الصلب.
الخصائص الكيميائية والفيزيائية
الاهتزازات الهيكلية والجزيئية
الرسم البياني المداري الجزيئي § تناظر ثاني أكسيد الكربون لجزيء ثاني أكسيد الكربون في هندسة توازنه خطي ومركز التماثل. يبلغ طول رابطة الكربون والأكسجين في ثاني أكسيد الكربون 116.3 ، وهو أقصر بكثير من طول حوالي 140 ميكرومتر لرابطة C-O النموذجية وأقصر من المجموعات الوظيفية الأخرى مع روابط C-O متعددة مثل carbonyls. نظرًا لأن الجزيء متماثل ، فليس له عزم كهربائي ثنائي القطب.
في محلول مائي
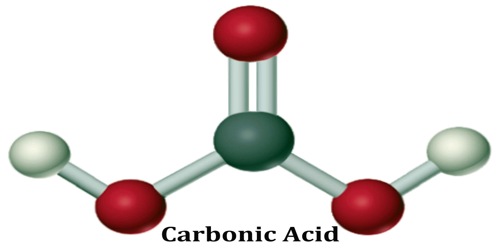
حمض الكربونيك هو ثاني أكسيد الكربون المذاب في الماء ، حيث يشكل H. ثاني أكسيد الكربون (حمض الكربونيك) هو حمض ضعيف لأنه يتأين بشكل غير كامل في الماء.
التفاعلات الكيميائية لثاني أكسيد الكربون
ثاني أكسيد الكربون عبارة عن مركب كهربائي قوي له تفاعل إلكتروفيلي مماثل لتفاعل البنزالديهيد أو مركبات الكربونيل ألفا وبيتا غير المشبعة. ومع ذلك ، على عكس المركبات الكهربائية التفاعلية المماثلة ، فإن التفاعلات المحبة للنووية مع ثاني أكسيد الكربون أقل تفضيلًا من الناحية الديناميكية الحرارية وغالبًا ما تكون قابلة للعكس بدرجة كبيرة. فقط النيوكليوفيلات القوية جدًا ، مثل الكربونات التي توفرها كواشف Grignard ومركبات الليثيوم العضوية ، تتفاعل مع ثاني أكسيد الكربون لتكوين الكربوكسيل.
الخصائص البدنية
حبيبات "الجليد الجاف" هي الشكل الشائع لثاني أكسيد الكربون الصلب وثاني أكسيد الكربون عديم اللون. عند التركيزات المنخفضة ، يكون الغاز عديم الرائحة. ومع ذلك ، في التركيزات العالية بما فيه الكفاية ، لها رائحة حمضية نفاذة. يقف في درجة الحرارة والضغط